摘要:这篇文章主要介绍了原电池的工作原理,需要的朋友可以参考下,如果你喜欢还可以浏览原电池的工作原理的最新相关推荐信息。
原电池的工作原理是什么?
把锌板和铜板平行放入盛有稀硫酸的烧杯里,用连有电流计的导线连接两极时,可以观察到三个重要的现象:锌片溶解,铜片上有气体逸出,导线中有电流通过。
透锌电极发生的电极反应式是:
锌片 Zn-2e=Zn2+ (氧化反应)
锌失去的电子沿导线经电流计流入铜片,溶液里的在铜电极上得到电子变为氢原子,进而结合为氢分子,铜电极发生的电极反应式是:
铜片 2H++2eH2↑ (还原反应)
由于在锌、铜两个电极上不断发生的氧化还原反应,使化学能转变为电能。锌片是给出电子的一极,是电池的负极,铜片是电子流入的一极,是电池的正极。电流的方向同电子流的方向相反,从正极铜流向负极锌。
原电池的工作原理是什么?
把锌板和铜板平行放入盛有稀硫酸的烧杯里,用连有电流计的导线连接两极时,可以观察到三个重要的现象:锌片溶解,铜片上有气体逸出,导线中有电流通过。
透锌电极发生的电极反应式是: 锌片 Zn-2e=Zn2+ (氧化反应) 锌失去的电子沿导线经电流计流入铜片,溶液里的在铜电极上得到电子变为氢原子,进而结合为氢分子,铜电极发生的电极反应式是: 铜片 2H++2eH2↑ (还原反应) 由于在锌、铜两个电极上不断发生的氧化还原反应,使化学能转变为电能。锌片是给出电子的一极,是电池的负极,铜片是电子流入的一极,是电池的正极。
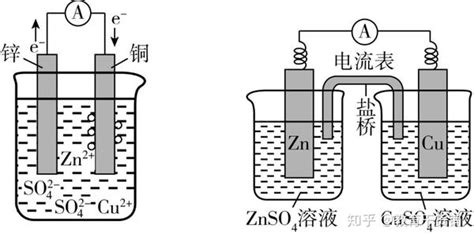
电流的方向同电子流的方向相反,从正极铜流向负极锌。
【原电池的原理及应用】
铅蓄电池常用于汽车,很笨重,可充电. 干电池 Zn - Mn 电池 (干电池) 中央的炭棒是正极板,其周围有MnO2 , 锌皮是负极.两极间有 NH4Cl , ZnCl2 和淀粉,呈糊状 银锌电池 银锌电池 电子手表,计算器使用的纽扣电池是银锌电池 . 燃料电池 燃料电池 若将 H2 或碳氢化合物的燃烧反应以电池方式进行,则形成燃料电池.以燃料电池的方式实现这一能量转化,比起燃烧放热再发电,能量转化率要高得多 电池反应 2H2 + O2 —— 2 H2O 是自发反应.燃料电池是否成功的关键在于选择适当的电极材料和催化剂,使得反应物能够顺利进行电极反应.燃料电池的关键是动力学问题. 阿波罗登月飞行和航天飞机已经应用了燃料电池,在纽约和东京已有燃料电池发电站在运转.。(商盟百科网chnore.com)
原电池的原理
条件即是原理
构成原电池的条件有:
(1)电极材料。两种金属活动性不同的金属或金属和其它导电性(非金属或某些氧化物等);
(2)两电极必须浸没在电解质溶液中;
(3)两电极之间要用导线连接,形成闭合回路。
说明:
①一般来说,能与电解质溶液中的某种成分发生氧化反应的是原电池的负极。
②很活泼的金属单质一般不作做原电池的负极,如K、Na、Ca等。
二、原电池正负极的判断
(1)由组成原电池的两极材料判断:一般来说,较活泼的或能和电解质溶液反应的金属为负极,较不活泼的金属或能导电的非金属为正极。但具体情况还要看电解质溶液,如镁、铝电极在稀硫酸在中构成原电池,镁为负极,铝为正极;但镁、铝电极在氢氧化钠溶液中形成原电池时,由于是铝和氢氧化钠溶液发生反应,失去电子,因此铝为负极,镁为正极。
(2)根据外电路电流的方向或电子的流向判断:在原电池的外电路,电流由正极流向负极,电子由负极流向正极。
(3)根据内电路离子的移动方向判断:在原电池电解质溶液中,阳离子移向正极,阴离子移向负极。(商盟百科网chnore.com)
(4)根据原电池两极发生的化学反应判断:原电池中,负极总是发生氧化反应,正极总是发生还原反应。因此可以根据总化学方程式中化合价的升降来判断。
5)根据电极质量的变化判断:原电池工作后,若某一极质量增加,说明溶液中的阳离子在该电极得电子,该电极为正极,活泼性较弱;如果某一电极质量减轻,说明该电极溶解,电极为负极,活泼性较强。
(6)根据电极上产生的气体判断:原电池工作后,如果一电极上产生气体,通常是因为该电极发生了析出氢的反应,说明该电极为正极,活动性较弱。
(7)根据某电极附近pH的变化判断
析氢或吸氧的电极反应发生后,均能使该电极附近电解质溶液的pH增大,因而原电池工作后,该电极附近的pH增大了,说明该电极为正极,金属活动性较弱。
三、电极反应式的书写
(1)准确判断原电池的正负极是书写电极反应的关键
如果原电池的正负极判断失误,电极反应式的书写一定错误。上述判断正负极的方法是一般方法,但不是绝对的,例如铜片和铝片同时插入浓硝酸溶液中,由于铝片表明的钝化,这时铜失去电子,是负极,其电极反应为:
负极:Cu -2e- = Cu2+
正极:NO3- + 4H+ + 2e- = 2H2O + 2NO2↑
再如镁片和铝片同时插入氢氧化钠溶液中,虽然镁比铝活泼,但由于镁不与氢氧化钠反应,而铝却反应,失去电子,是负极,其电极反应为:
负极:2Al + 8OH--2*3e- =2AlO2- + 2H2O
正极:6H2O + 6e- = 6OH- + 3H2↑(商盟百科网chnore.com)
(2)要注意电解质溶液的酸碱性
在正负极上发生的电极反应不是孤立的,它往往与电解质溶液紧密联系,如氢氧燃料电池有酸式和碱式,在酸溶液中,电极反应式中不能出现OH-,在碱溶液中,电极反应式中不 能出现H+,像CH4、CH3OH等燃料电池,在碱溶液中碳(C)元素以CO32-离子形式存在,而不是放出CO2气体。
(3)要考虑电子的转移数目
在同一个原电池中,负极失去电子数必然等于正极得到的电子数,所以在书写电极反应时,一定要考虑电荷守恒。防止由总反应方程式改写成电极反应式时所带来的失误,同时也可避免在有关计算中产生误差。
(4)要利用总的反应方程式
从理论上讲,任何一个自发的氧化还原反应均可设计成原电池,而两个电极反应相加即得总反应方程式。所以只要知道总反应方程式和其中一个电极反应,便可以写出另一个电极反应方程式。
原电池的原理~~
以最简单的铜锌原电池为例:
正极:铜棒插在硫酸铜溶液中(形成了Cu2+/Cu氧化还原电对),
负极:锌棒插在硫酸锌溶液中,(形成了Zn2+/Zn氧化还原电对)
两个溶液之间用盐桥(氯化钾饱和溶液)连接,铜棒和锌棒之间用导线连接,这样就构成了原电池.
那么电子就会从负极流向正极,你要问的就是为什么电子要定向流动.不知道你学过标准电极电势的概念没有,这个值是可以通过实验测到的,由于单质锌和锌离子构成的氧化还原电对的标准电极电势比单质铜和铜离子构成的氧化还原电对的标准电极电势小是个负值(规定标准氢电极的电极电势是0),而铜电极是个正值,所以当用导线将两个电极连接起来时,由于两个电极之间电势差的存在,电子会从负极流向负极,而电流的方向是正极流向负极,与电子流动的方向相反,就像我们常说的水往低处流,就是由于高地势与低地势之间存在高度差(地势差),是个自发的过程.
利用标准电极电势还可以知道金属的活泼性,电极电势越小那么金属单质的活泼性越强,我们在化学课上学过,金属有个活动顺序表:钾,钙,钠,镁,铝,锌,铁,锡,铅,氢,铜,汞,银,铂,金;这个表就是根据标准电极电势的值来排列出来的,我们从这个表中可知在氢前的金属单质可以将氢从溶液当中置换出来,刚才说过规定标准氢电极的电极电势是0,所以在氢之前的金属与其阳离子构成的氧化还原电对的标准电极电势是小于0的,而在氢之后的金属其标准电极电势是大于0的.(商盟百科网chnore.com)
不知道你明白没有?
原电池的原理及应用
铅蓄电池 铅蓄电池常用于汽车,很笨重,可充电。
干电池 Zn - Mn 电池 (干电池) 中央的炭棒是正极板,其周围有MnO2 , 锌皮是负极。两极间有 NH4Cl , ZnCl2 和淀粉,呈糊状 银锌电池 银锌电池 电子手表,计算器使用的纽扣电池是银锌电池 。
燃料电池 燃料电池 若将 H2 或碳氢化合物的燃烧反应以电池方式进行,则形成燃料电池。以燃料电池的方式实现这一能量转化,比起燃烧放热再发电,能量转化率要高得多 电池反应 2H2 + O2 —— 2 H2O 是自发反应。
燃料电池是否成功的关键在于选择适当的电极材料和催化剂,使得反应物能够顺利进行电极反应。燃料电池的关键是动力学问题。
阿波罗登月飞行和航天飞机已经应用了燃料电池,在纽约和东京已有燃料电池发电站在运转。
原电池的原理
化学原理:两种活泼性不同的金属(或石墨)(Pt和石墨为惰性电极,电解质溶液中为离子导电,产生电流.又称非蓄电池,即本身不会得失电子)用导线连接后插入电解质溶液中。
电流的产生是由于氧化反应和还原反应分别在两个电极上进行的结果,将化学能转换为电能。负极本身易失电子发生氧化反应,电子沿导线流向正极,正极上一般为电解质溶液中的阳离子得电子发生还原反应。
在原电池中,外电路为电子导电。一般情况下,原电池中,较活泼的金属做负极,较不活泼的金属做正极物理原理:利用两个电极之间金属性的不同,产生电势差,从而使电子的流动。
原电池的工作原理(原电池的工作原理的最新相关信息)










